ユビキチン-プロテアソーム系とオートファジー
皆さんは「ユビキチン-プロテアソーム系」や「オートファジー(自食作用ともいいます)」という言葉を聞いたことがありますでしょうか。これらの仕組みを発見・解明した偉大な研究者たちがノーベル賞をご受賞されたことでも有名ですね。このユビキチン-プロテアソーム系やオートファジーは、それぞれの細胞がもっている「不要になったタンパク質を分解するシステム」のことです。ここでは、これらの細胞内のタンパク質分解システムの仕組みについて学んでいきましょう。
1. タンパク質分解システムの発見と仕組みの解明
私たちの身体を構成している細胞の中では、常にさまざまなタンパク質が合成されては分解されることが繰り返される(これをターンオーバーといいます)ことによって、細胞内の恒常性(内部環境を一定に保ち生命を維持する性質)が維持されています。
多くの遺伝子はmRNAへと変換(転写)されて、その後タンパク質へと合成(翻訳)されることによって細胞内で機能しています。そのため、タンパク質の合成の仕組みは、生命活動を維持するために非常に重要な機構であることは明らかです。
一方で、細胞内の恒常性を維持するという意味では、タンパク質が適切に分解されることも非常に重要です。不要なタンパク質が細胞内に蓄積すると、細胞内の恒常性が破綻し、これがさまざまな疾患の原因となっていることが明らかになってきています。
このようにタンパク質分解の仕組みを理解することはとても重要なことなのですが、これらのタンパク質分解システムの発見とその仕組みの解明においては、ユビキチン-プロテアソーム系の発見が『2004年のノーベル化学賞』に選ばれ、オートファジーの仕組みの解明が『2016年のノーベル医学・生理学賞』に選ばれました。

2. ユビキチン-プロテアソーム系
ユビキチン-プロテアソーム系によるタンパク質分解では、まず、ユビキチン(76個のアミノ酸からなるタンパク質、タンパク質分解のための目印となる)と呼ばれるタンパク質が不要になったタンパク質にたくさん付加されます。
その後、ユビキチン化されたタンパク質が、プロテアソームと呼ばれるタンパク質の分解装置によって分解されます(一般的にはユビキチンの48番目のリジン残基がポリユビキチン化されることがプロテアソーム分解を受ける目印となります)。

※ここでの不要になったタンパク質とは、変性したタンパク質などのことをいいます。
○ユビキチン-プロテアソーム系の流れ
ユビキチン-プロテアソーム系によるタンパク質分解を簡単にまとめると以下のようになります。
ポイント
①分解の標的になるタンパク質にユビキチンが多数付加される(不要なタンパク質のポリユビキチン化)
②ポリユビキチン化されたタンパク質がプロテアソームに認識される
③プロテアソーム内に取り込まれてペプチド(アミノ酸がペプチド結合で複数つながったもの)にまで分解される
※生じたペプチドは、さらに別のプロテアーゼによって分解されます。
ユビキチン-プロテアソーム系の特徴として、ユビキチン化されたタンパク質を選択的に分解するということが挙げられます。また、この反応にはATPのエネルギーが必要であることも知っておきましょう。
○タンパク質のユビキチン化の過程

このユビキチン化の反応は、
3つのユビキチン化酵素(E1ユビキチン活性化酵素、E2ユビキチン結合酵素、E3ユビキチンリガーゼ)
によって段階的に行われています。
※リガーゼとは、ATPなどの分解に伴って2つの基質を結合する反応を触媒する酵素のことです。
3つの段階は全て重要な過程ですが、
中でも特に重要(実際にユビキチンを標的タンパク質に付加するのに必要)なのが、
ユビキチンリガーゼ(E3酵素)という酵素です。
このことを念頭に置いて、以下の過程を見ていきましょう。

引用元:https://commons.wikimedia.org/wiki/File:Ubiquitylation.png
①第一段階:E1酵素にユビキチンが結合する
まず最初の段階では、ユビキチン活性化酵素(E1酵素)が、ATPのエネルギーを利用してE1酵素自身にユビキチンを結合させます。
②第二段階:E1酵素からE2酵素へユビキチンが受け渡される
その後、E1酵素に付加されたユビキチンがユビキチン結合酵素(E2酵素)へと受け渡されます。
③第三段階:E3酵素によって標的タンパク質がユビキチン化される
E2酵素は標的タンパク質には直接結合することができません。
つまり、E2酵素に付加されたユビキチンを標的タンパク質に付加させるためには、E2酵素と標的タンパク質の両方に結合し、E2酵素に付加されていたユビキチンを標的タンパク質へと移す反応を触媒する酵素が必要になります。
この働きをするのがユビキチンリガーゼ(E3酵素)です。
E2酵素と標的タンパク質の間を橋渡しして、ユビキチンを標的タンパク質に付加させる酵素であるというようなイメージをもつとわかりやすいかもしれません。
この3つの段階の反応は何度も繰り返されることによって、標的タンパク質にユビキチンがたくさん付加されていきます(ポリユビキチン化)。
※このようにしてできたポリユビキチン化タンパク質は、プロテアソームによってATP依存的に分解されていきます。
3. オートファジー
オートファジーによるタンパク質分解では、
まず不要となったタンパク質の周囲を囲むように隔離膜と呼ばれる膜構造が形成されます。
そして、この隔離膜が閉じることによって、二重膜で囲まれたオートファゴソームと呼ばれる小胞ができます。
最後に、オートファゴソームがリソソーム(タンパク質を分解するための様々な加水分解酵素を含む)と融合することで、内部のタンパク質がアミノ酸にまで分解されます。
オートファジーでは、不要になったタンパク質だけではなく細胞小器官(オルガネラ)も分解されます。
○オートファジーの流れ
オートファジーによるタンパク質分解を簡単にまとめると以下のようになります。
ポイント ①不要になったタンパク質が隔離膜に包まれて、オートファゴソームを形成する。
②オートファゴソームとリソソームが融合する(オートリソソームの形成)
③リソソーム内のタンパク質分解酵素などによって内容物が分解される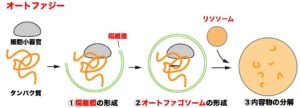
※オートファジーは、アミノ酸飢餓や変性タンパク質の蓄積などの条件下で特に活性化され、不要なタンパク質を分解することで(アミノ酸の供給源となることで)、生体の恒常性維持に重要な役割を果たします。
○選択的オートファジーと非選択的オートファジー
このオートファジーですが、細胞内でオートファゴソームを形成し、包み込んだ内容物を丸ごと分解することから、非選択的に不要な物質を分解するシステムであると考えられていました。
しかしながら、近年、不要になったミトコンドリアやリボソームなどの細胞小器官、あるいは凝集タンパク質のユビキチン化を指標に、これらを選択的に分解するシステムも存在することが明らかになっています。
これらは、「選択的オートファジー」と呼ばれています。例えば、ミトコンドリアをオートファジーで選択的に分解する「マイトファジー」、小胞体(ER:Endoplasmic Reticulum)をオートファジーで選択的に分解する「ERファジー」、リボソームを選択的に分解する「リボファジー」などさまざまな選択的オートファジーの仕組みが見つかってきています。
これらの仕組みは、パーキンソン病の原因遺伝子の一つが、マイトファジーに関与するものであるというように、さまざまな疾患との関係においても重要であることがわかってきています。
【参考】
ユビキチン-プロテアソーム系とオートファジーについてはこれで以上です。
次は「1)シグナル分子やシグナル伝達の考え方【細胞間シグナル伝達】」について学んでいきましょう。
-
-
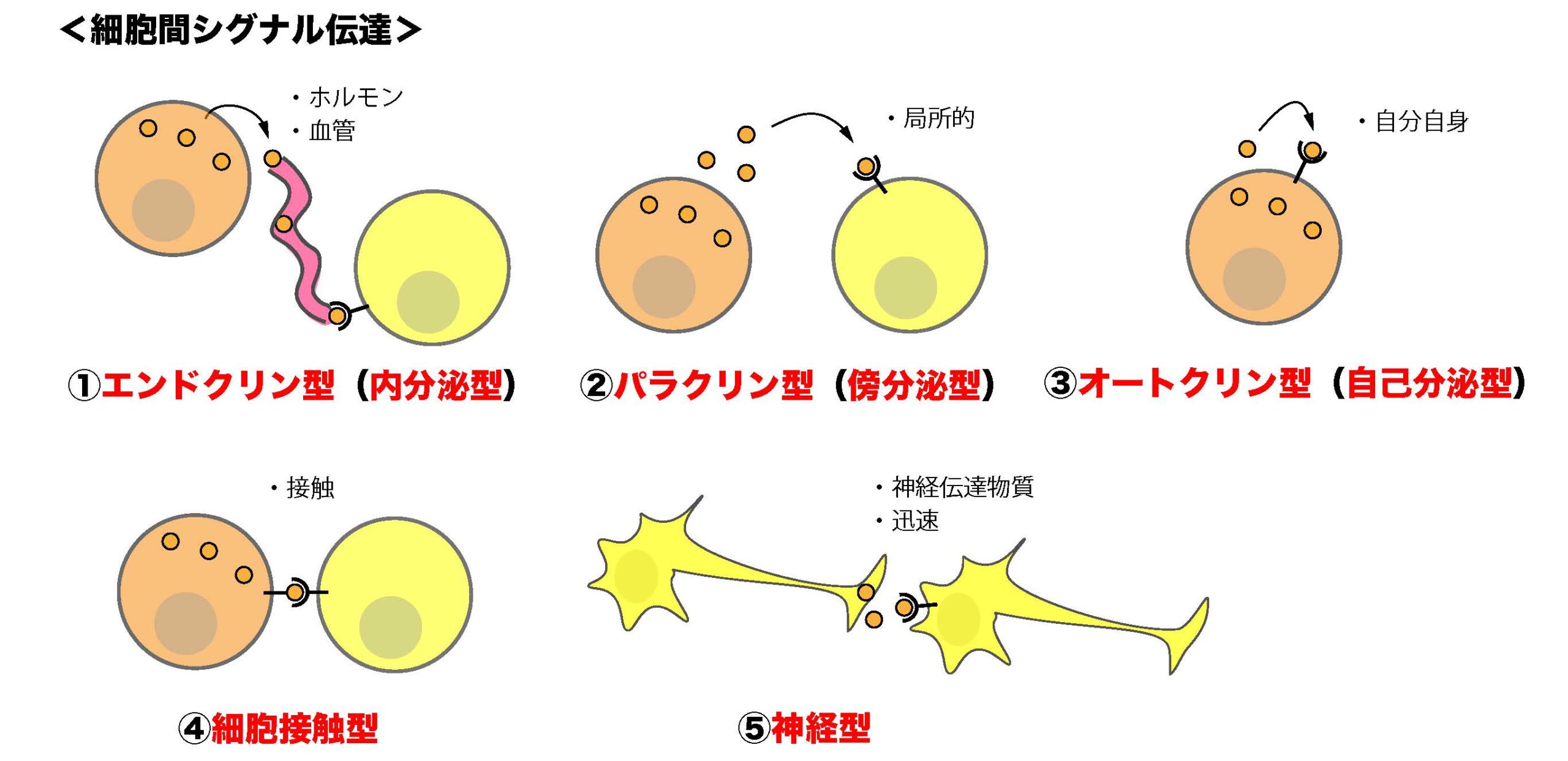
1)シグナル分子やシグナル伝達の考え方(①細胞間シグナル伝達)
シグナル分子やシグナル伝達の考え方 ①細胞間シグナル伝達 ここでは、シグナル分子やシグナル伝達の考え方について学んでいきましょう。 1. シグナル伝達とは? 例えば、食事を摂取することによって血糖値が ...
続きを見る


