アデノ随伴ウイルス(AAV)を用いた遺伝子導入法について
今回は、アデノ随伴ウイルス(AAV: adeno-associated virus)を用いた遺伝子導入法について解説していきます。
特に、遺伝子導入法の種類、ウイルスベクターの種類、アデノ随伴ウイルス(AAV)の特徴と利点などを中心に解説していきます。

遺伝子導入法にはいくつかの種類があるので、それらも理解できるようになりましょう。
遺伝子導入法の種類
遺伝子導入は、目的とする遺伝子を細胞・組織内に導入し、その機能や発現を調べるための重要な技術です。
代表的な遺伝子導入法には、
3つの代表的な遺伝子導入法
①トランスフェクション法
②エレクトロポレーション法
③ウイルスベクターを用いた方法
の3種類があります。
遺伝子導入法 1. トランスフェクション
トランスフェクションは、化学的に遺伝子を細胞内に導入する手法です。
主に、陽イオン性脂質や陽イオン性ポリマーなどを使用し、これらが核酸と複合体を形成することで細胞膜を通じた効率的な送達が可能になります。
比較的手軽に行える反面、効率が細胞種によって異なるため最適化が必要です。


核酸(DNAやRNA)はマイナス(−)の電荷をもっているので、プラス(+)の電荷をもつ陽イオン性脂質や陽イオン性ポリマーなどに結合して複合体を形成します。
この複合体が、エンドサイトーシスによって細胞に取り込まれるため、遺伝子を細胞内に導入できます。
遺伝子導入法2. エレクトロポレーション
エレクトロポレーションは、物理的に短時間の電気パルスを細胞に与え、一時的に細胞膜に穴をあけて遺伝子を導入する手法です。
この方法は目的の場所に効率よく遺伝子を導入することが可能である反面、専用の装置が必要です。

遺伝子導入法3. ウイルスベクターを用いた遺伝子導入
ウイルスベクターは、生物学的にウイルスを利用して目的遺伝子を細胞内に送達する方法です。
ウイルスは自然に細胞に遺伝物質を運ぶ能力を持っていますので、高い効率で遺伝子導入ができます。

特に、遺伝子治療や遺伝子改変動物の作製に広く用いられています。
遺伝子導入に使用される主なウイルスベクター
次に、ウイルスベクターを用いた遺伝子導入法に関して、最もよく使用される代表的なウイルスベクターについて確認していきましょう。
代表的なウイルスベクターには、
4つの代表的なウイルスベクター
①レトロウイルス
②レンチウイルス
③アデノウイルス
④アデノ随伴ウイルス
の4種類があります。
1. レトロウイルス
レトロウイルスは、細胞分裂を行う増殖細胞に対して高い感染効率を示します。
導入された遺伝子が宿主のDNAに組み込まれるため、長期的な遺伝子発現の誘導が可能です。
拡散防止措置レベルは、P2レベルです。

拡散防止措置レベルのP1やP2に関しては以下の記事で解説していますので、確認してみてください。
<拡散防止措置レベルのP1やP2に関して:記事作成中>
2. レンチウイルス
レンチウイルスは、増殖細胞に加えて、非分裂細胞にも遺伝子導入できる点が特徴です。
特に神経細胞や免疫細胞など、多様な細胞種に適用可能です。
レトロウイルスと同様に、導入された遺伝子が宿主のDNAに組み込まれるため、長期的な発現が可能です。
拡散防止措置レベルは、P2レベルです。
3. アデノウイルス
アデノウイルスは、宿主ゲノムに組み込まれずに遺伝子を導入することができます。
この特性により、一過性の発現が必要な場合に適しています。
拡散防止措置レベルは、P2レベルです。
4. アデノ随伴ウイルス(AAV)
アデノ随伴ウイルス(AAV:adeno-associated virus)は、非病原性のDNAウイルスであり、遺伝子治療において非常に注目されています。
一過性の発現ですが、非分裂細胞に遺伝子導入する場合には、長期的な発現が可能です。
特に注目すべき点は、拡散防止措置レベルが、P1レベルであることです。

一過性発現と安定発現について
遺伝子導入後の遺伝子発現は、「一過性発現(Transient Expression)」と「安定発現(Stable Expression)」の2種類に分類されます。
それぞれの特徴を以下に簡単に解説します。
◯ 一過性発現(Transient Expression)
外来遺伝子が細胞内で一時的に発現することを「一過性発現(Transient Expression:トランジェントエクスプレッション)」といいます。
遺伝子は細胞核内に存在しますが、ゲノムに組み込まれることはありません。
ポイント
・発現は短期間(数日から1週間程度)で消失します。
・遺伝子導入が簡単で、短期間で実験結果を得られます。
・遺伝子の組換えのリスクがないため安全性が高いです。
◯ 安定発現(Stable Expression)
外来遺伝子が宿主細胞のゲノムに組み込まれ、細胞分裂後も持続的に発現することを「安定発現(Stable Expression:ステイブルエクスプレッション)」といいます。
ポイント
・遺伝子発現が長期間、持続します。
・外来遺伝子を持つ細胞クローンを薬剤で選別・維持する必要があります。
・作製には時間と労力がかかります。
遺伝子治療の分野で注目を集めているのが、アデノ随伴ウイルス(AAV)です。
次に、アデノ随伴ウイルス(AAV)の特徴、AAVを作製するために必要なベクターの種類などを中心に確認していきましょう。
アデノ随伴ウイルス(AAV)の特徴
アデノ随伴ウイルス(AAV:adeno-associated virus)は、小型のDNAウイルスで、以下の特徴があります。重要なポイントなので再確認していきましょう:
- 非病原性:自然界では人に感染しても病気を引き起こしません。P1レベルで実験ができるので、医学分野などの研究で非常によく使用されています。
- 宿主ゲノムへの挿入が稀:宿主のゲノムにランダムに挿入される可能性が低く、安全性が高いと考えられています。
- 長期的な遺伝子発現:エピソームとして細胞内で安定して存在し、長期的な遺伝子発現を可能にします。
AAVを作製するために必要な3種類のプラスミド
アデノ随伴ウイルス(AAV)を用いた遺伝子導入では、以下の3種類のプラスミドが使用されます。
アデノ随伴ウイルスは、その名の通り、アデノウイルスが共存することで効率的に複製・パッケージングされ、ウイルスの遺伝子を細胞内に導入することができます。
遺伝子導入実験では、アデノウイルスそのものを用いるのではなく、アデノウイルス由来の補助遺伝子を含むプラスミドベクターを同時に細胞内に導入します。
AAVを作製するために必要な3種類のプラスミド
①AAVベクタープラスミド:目的遺伝子を含むAAVベクターです。目的遺伝子(GOI: Gene of Interest)、プロモーター、ITRが含まれており、目的遺伝子を発現させるために必要です。
②AAVヘルパープラスミド:AAVのRep(複製)およびCap(カプシド)遺伝子を提供するヘルパープラスミドです。これにより、AAVウイルス粒子の複製とカプシドの形成が可能になります。
③アデノウイルスヘルパープラスミド: アデノウイルスの遺伝子を提供し、AAVの複製とパッケージングに必要な補助因子を供給します。このプラスミドは、AAVウイルス粒子の生成を助けます。
AAVベクタープラスミドの構造
AAVベクタープラスミドは、以下の要素から構成されています:
・ITR(Inverted Terminal Repeat): ウイルスゲノムの両端に存在する配列で、複製の開始点となるだけでなく、ウイルス粒子へのパッケージングにも必要な配列です。
・プロモーター: 目的遺伝子の発現を制御します。
・目的遺伝子(GOI: Gene of Interest): クローニングした目的の遺伝子(発現させたい遺伝子)です。
アデノ随伴ウイルスは、ウイルスのサイズが小さく、導入できる目的遺伝子のサイズには制限がある(2.5kb程度まで)ことに注意が必要です。
AAVヘルパープラスミドの構造
AAVベクタープラスミドは、以下の要素から構成されています:
・Rep(Replicase:レプリカーゼ): ウイルスの複製に必要なタンパク質をコードし、AAVゲノムの複製や組み込みに関与します。
・Cap(Capsid protein:カプシド): ウイルスカプシド(ウイルスの外殻タンパク質)をコードし、AAV粒子の形成や細胞感染能を担います。
アデノ随伴ウイルス(AAV)による遺伝子導入の流れ
アデノ随伴ウイルス(AAV)を用いた遺伝子導入の流れ
AAVを用いた遺伝子導入の一般的なプロセスは以下の通りです:

-
AAVベクタープラスミドへの目的遺伝子(GOI: Gene of Interest)・プロモーターのクローニング
→対象となる遺伝子とプロモーターをベクタープラスミド(AAVベクタープラスミド)にクローニングします。
-
AAVヘルパープラスミドの選択–AAVの血清型の選択
→どのようなカプシドをコードするAAVベクターを使用するかを選択します。
-
HEK293細胞などに3種類のプラスミドを共トランスフェクション
→宿主細胞に①AAVベクタープラスミド、②AAVヘルパープラスミド、③アデノウイルスヘルパープラスミドを共トランスフェクション(Co-transfection:コトランスフェクション)します。
-
ウイルス粒子の回収
→2〜3日培養した後に、トランスフェクションした細胞を回収します。その後、細胞からキットなどを用いて、AAVを回収します。
-
AAVの精製・濃縮
→超遠心法や市販のキットを用いてウイルス粒子を精製します。
-
ウイルスベクターの力価の測定
→AAVのベクターDNAをリアルタイムPCRで定量することなどによって、ウイルスベクターの濃度を測定します。
-
AAV投与
→標的組織や細胞に適切な投与方法(静脈内注射、局所注入など)で精製したAAVを投与します。
-
遺伝子発現の確認
→目的遺伝子の発現をqRT-PCRやウェスタンブロットで確認します。
ステップ1. AAVベクタープラスミドへの目的遺伝子・プロモーターのクローニング
まず初めに、①AAVベクタープラスミドに目的遺伝子(GOI: Gene of Interest)をクローニングします。
この際に、目的の遺伝子上流のプロモーターを選択します(組織特異的なプロモーターを使用するか?など)。
- 適切なAAVベクタープラスミドを選択します。
- 目的遺伝子(GOI)とプロモーターをAAVベクタープラスミドにクローニングします。
- 組換えプラスミドを大腸菌で増幅後、プラスミドを精製します。
クローニングと組換えプラスミドの大腸菌での増幅については、「大腸菌の形質転換について」で解説をしていますのでご覧ください。
-
-
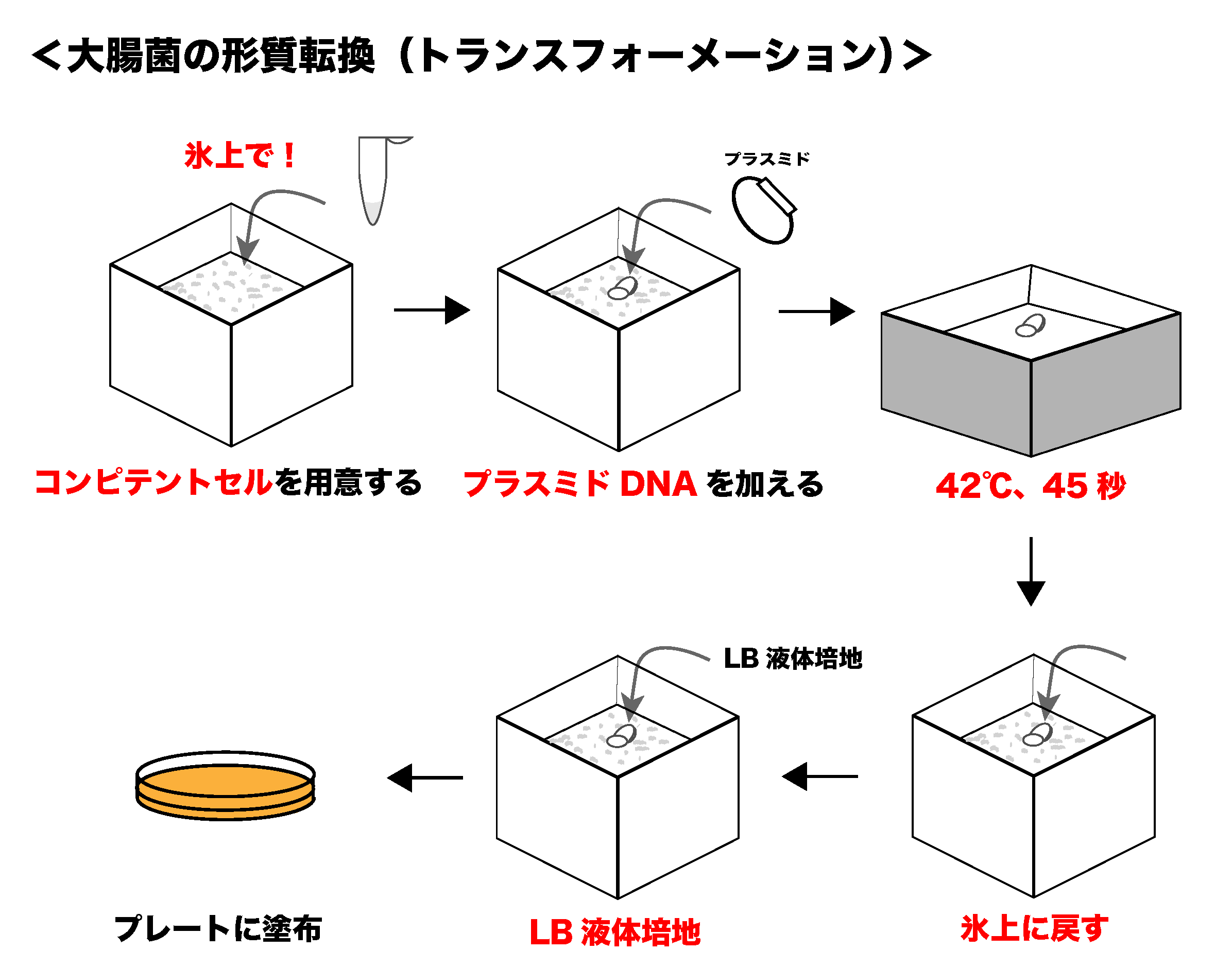
大腸菌の形質転換について
大腸菌の形質転換について ここでは「大腸菌の形質転換」について学んでいきます。これらの操作は、例えば「ある遺伝子の機能を調べたいとき」に用いられるような「基本的な実験操作」となりますので、原理と流れ ...
続きを見る
プラスミドの精製については、「プラスミドDNAの抽出」で解説をしていますのでご覧ください。
-
-
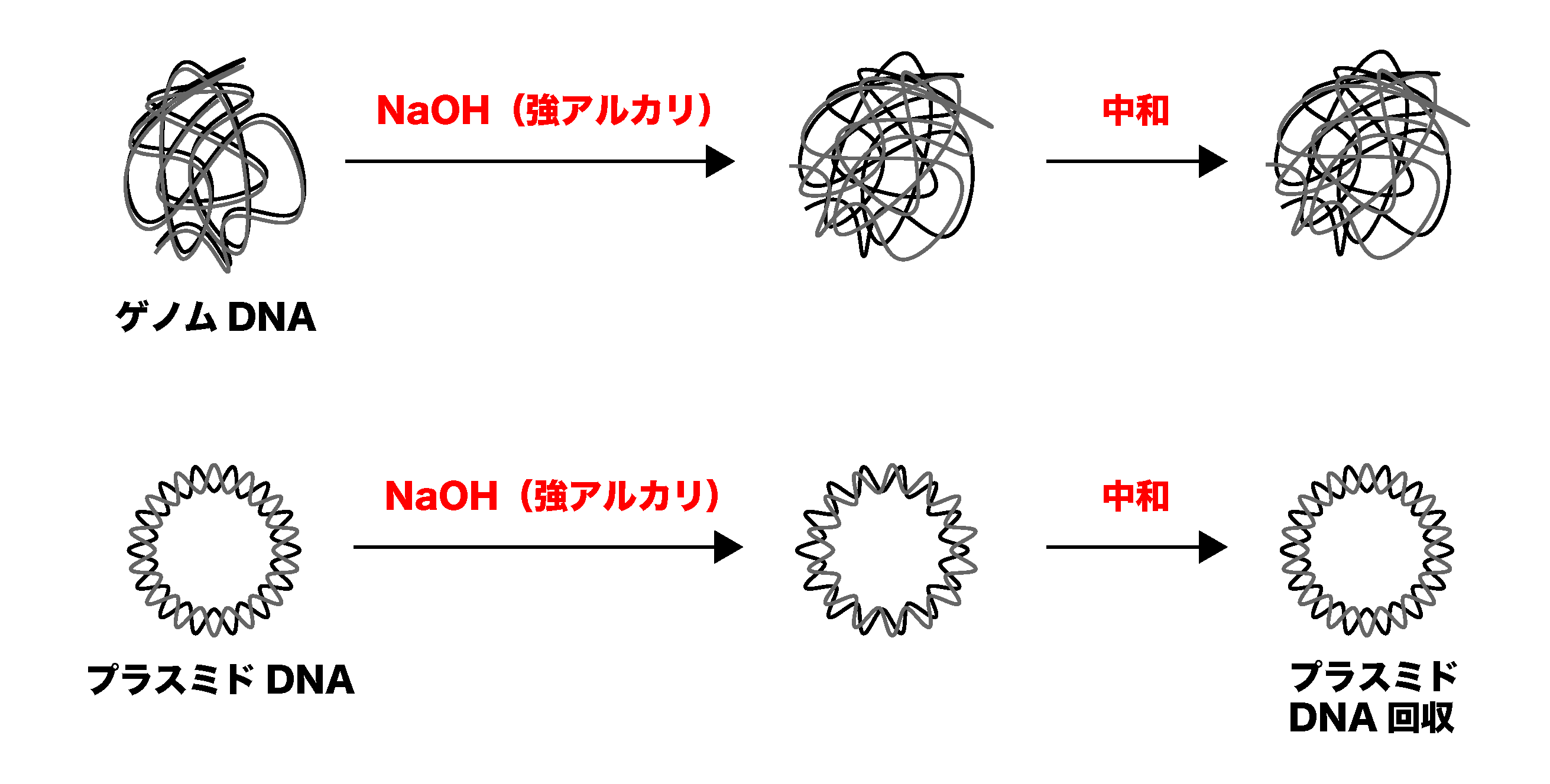
プラスミドDNAの抽出
プラスミドDNAの抽出 前項では「大腸菌の形質転換について」を学びました。本項では大腸菌を形質転換した後に行われる「プラスミドDNAの抽出」について学んでいきましょう。 1.アルカリ変性法の原理 「細 ...
続きを見る
AAVベクタープラスミドを用いた遺伝子発現は、プロモーターの選択によって制御できます。例としては、以下のようなものがあります。
プロモーターの例
- CAGプロモーター: 広範囲の細胞で強力な発現を示す。
- hSynプロモーター: 神経細胞特異的。
- MCKプロモーター: 筋細胞特異的。
ステップ2. AAVヘルパープラスミドの選択-AAVの血清型の選択
次に、②AAVヘルパープラスミドを選択します。
AAV(アデノ随伴ウイルス)のカプシドは、遺伝子送達効率や組織特異性を決定する重要な要素です。
AAVには1〜13など複数のセロタイプが存在しており、各セロタイプは異なる組織への指向性(=特定の組織や細胞を優先的に標的とする性質)を持ちます(例えば、AAV8は肝臓指向性、AAV9は心臓や中枢神経系への送達に優れるなどです)。
ポイント
「セロタイプ(serotype)」とは、ウイルスや細菌のカプシドや表面抗原の違いによって分類される型(血清型)のことです。
AAVの場合、セロタイプは異なるカプシドタンパク質の構造によって決定され、それによりウイルスの標的組織や細胞への指向性が異なります。
たとえば、AAV2は神経系に効率よく送達でき、AAV8は肝臓指向性が高いという特徴があります。
AAVのセロタイプの選択により、目的の組織に特異的に遺伝子を送達することが可能です。
以下に、AAVのセロタイプと組織特異性をまとめておきます。
ステップ3. HEK293細胞への3種類のプラスミドの共トランスフェクション
宿主細胞に①AAVベクタープラスミド、②AAVヘルパープラスミド、③アデノウイルスヘルパープラスミドを共トランスフェクション(Co-transfection:コトランスフェクション)します。
3種類のプラスミドを無血清培地(例:Opti-MEM)で最適濃度に希釈します。
上記をトランスフェクション試薬と混合し、室温で20分ほど静置して3種類のプラスミドとトランスフェクション試薬の複合体を形成させます。
培養中のHEK293細胞の培地を交換し、3種類のプラスミドとトランスフェクション試薬の混合液(トランスフェクション液)を、細胞が入った培養プレートに追加で添加し、軽く揺らして均一に分散させます。
細胞を37°C、5% CO2環境で48–72時間培養など培養します。
ステップ4. ウイルス粒子の回収
48–72時間培養した後に、トランスフェクションした細胞を回収します。細胞をdishから剥がして、遠心分離し、細胞をチューブに回収します。
その後、細胞からキットなどを用いて、AAVを回収します。
ステップ5. AAVの精製・濃縮
超遠心法や市販のキットを用いてウイルス粒子を精製します。
ステップ6. ウイルスの力価の測定
AAVのベクターDNAをリアルタイムPCRで定量することなどによって、ウイルスベクターの濃度を測定します。
RT-qPCRについては、「3)リアルタイムPCRによる定量PCR」で解説をしていますのでご覧ください。
-
-
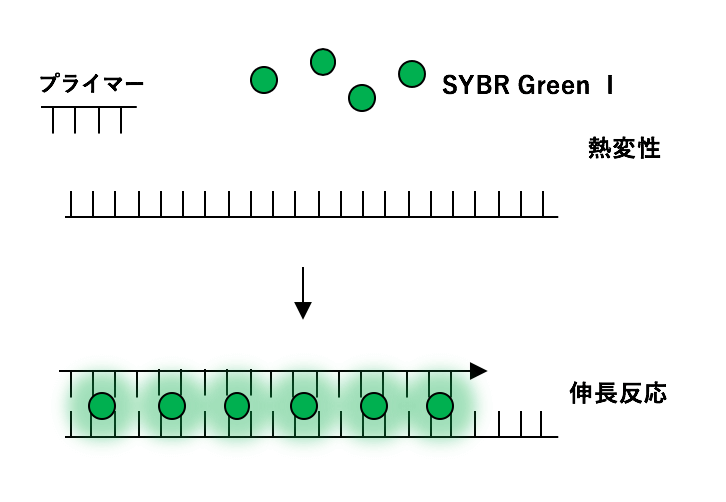
3)リアルタイムPCRによる定量PCR
1.リアルタイムPCRとは リアルタイムPCRとは、PCRによる増幅産物をリアルタイムでモニタリングすることで、増幅率に基づいて初期のDNAの定量ができる定量PCRのことです。 リアルタイムRT- ...
続きを見る
ステップ7. AAV投与
標的組織や細胞に適切な投与方法(静脈内注射、局所注入など)で精製したAAVを投与します。
ステップ8. 遺伝子発現の確認
目的遺伝子の発現をqRT-PCRやウェスタンブロットで確認します。
ウェスタンブロット法については、「2)ウエスタンブロッティング」で解説をしていますのでご覧ください。
-
-
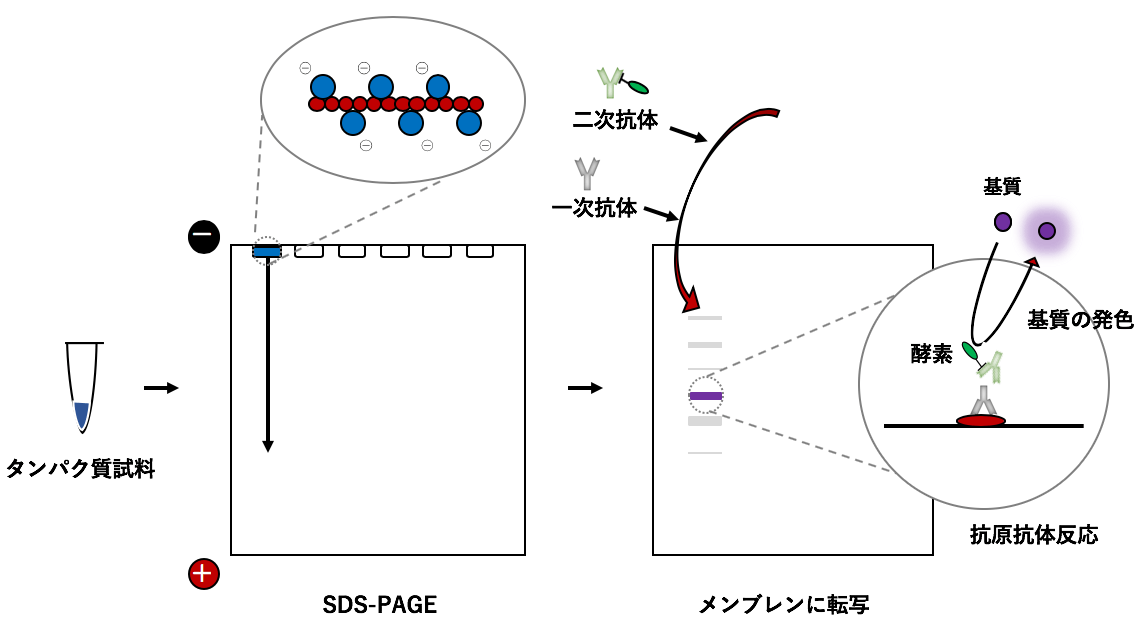
2)ウエスタンブロッティング
1.ウエスタンブロッティング(WB)とは ウエスタンブロッティングとは、SDS-PAGEによって分離したタンパク質を疎水性膜(メンブレン)に転写し、任意のタンパク質に対する抗体を用いて特定のタンパク ...
続きを見る
指向性進化によるAAVベクターの開発
AAVのカプシド部分にランダム変異を導入することなどで、特定の組織に特異性の高いAAVベクターなどが開発されています。
これは「指向性進化(Directed Evolution)」と呼ばれており、AAVのカプシドを進化させて新たな組織特異性や送達効率を向上させる手法です。
これにより、AAVのセロタイプを超えた新しいカプシドが開発されており、より効率的かつ特異的な遺伝子導入が可能なAAVベクターが開発されています。
最後に
AAVは非常に安全性が高く、遺伝子治療における標準的なベクターとして確立されています。
特に、CRISPR/Cas9技術との併用により、より精密なゲノム編集の実現が期待されています。
CRISPR/Cas9については、「新しいゲノム編集技術の発見 CRISPR/Cas9【2020年ノーベル化学賞】」で解説をしていますのでご覧ください。
-

-
新しいゲノム編集技術の発見 CRISPR/Cas9【2020年ノーベル化学賞】
ゲノム編集について 今回は、2020年ノーベル化学賞をご受賞された「新しいゲノム編集技術の開発」について、その内容を解説していきたいと思います。 1. ゲノム編集とは ゲノム編集(Genome edi ...
続きを見る
アデノ随伴ウイルス(AAV)を用いた遺伝子導入法についてはこれで以上です。
次は「1)反応速度と酵素反応速度」について学んでいきましょう。
-
-
1)反応速度と酵素反応速度
1.反応速度 反応速度とは、単位時間あたりの反応物(あるいは生成物)の濃度変化のことをいいます。 ○反応速度の定義 それでは、以下のような化学反応について考えてみましょう。 まず、 ...
続きを見る