1.ウエスタンブロッティング(WB)とは
ウエスタンブロッティングとは、SDS-PAGEによって分離したタンパク質を疎水性膜(メンブレン)に転写し、任意のタンパク質に対する抗体を用いて特定のタンパク質を検出する方法です。

DNAを検出するサザンブロッティングやRNAを検出するノーザンブロッティングにちなんで、タンパク質を検出する方法として「ウエスタンブロッティング」という名前がつけられました。
ちなみに、ブロッティングとは、ゲル中の物質を電気的にメンブレン膜に転写させる方法のことをいいます。
2.ウエスタンブロッティングの原理と概要
ウエスタンブロッティングでは、 SDS-PAGE後のゲルにメンブレンを密着させ、分離したタンパク質を電圧をかけてメンブレンに転写させます。その後、タンパク質が載っていない部位に抗体などが非特異的に結合することを防ぐためにブロッキングを行った後、一次抗体(特定のタンパク質に対する抗体)を作用させ、次に二次抗体(一次抗体に対する抗体)を作用させます。二次抗体にはあらかじめアルカリホスファターゼやペルオキシダーゼといった酵素が結合されているものを使用しますので、適当な基質を作用させることによってその位置で発色あるいは発光させると、目的タンパク質をバンドとして検出することができます。
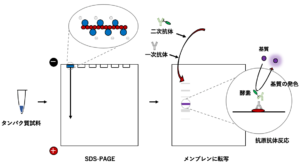
このような原理から、ウエスタンブロッティングではタンパク質の抗原性(抗体と特異的に結合する性質)と分子量の両方の性質を利用して目的タンパク質を検出することができます。そのため、同時に泳動する分子量マーカーのバンドの位置との比較から、予測した分子量とは違う位置でのバンドが得られた場合には、タンパク質の翻訳後修飾の新たな発見につながることもあります。
さらに、ウエスタンブロッティングでは、あらかじめ泳動するタンパク質の濃度を揃えておくことによって、サンプル中における目的タンパク質の発現の有無のみではなく、タンパク質の発現量の変化も測定することができます。
次に、ウェスタンブロット法の具体的な流れについて確認していきましょう。
3.ウェスタンブロット法の流れ
①タンパク質抽出
ウェスタンブロット法によって、タンパク質の発現の有無や発現量を解析するにあたって、サンプル調製をうまく行うことが大切になります。
まずはじめに、細胞や組織からタンパク質を抽出するために溶解バッファー(Lysis Buffer)を用意します(氷上)。
ここで注意しておきたい点として、細胞内(例:リソソーム内)にはさまざまなタンパク質分解酵素や脱リン酸化酵素が含まれているので、使用する溶解バッファーには、プロテアーゼ阻害剤(タンパク質分解を防ぐため)やホスファターゼ阻害剤(脱リン酸化を防ぐため)などを加えて置く必要があります。
※このときに使用する溶解バッファーの種類は、使用するサンプル(核タンパク質を見たいのかなど)に応じて適切に選択する必要があります。
溶解バッファーが準備できたら、組織や細胞に溶解バッファーを加えて破砕し、タンパク質を抽出していきます。
細胞の破砕などでは、超音波処理によって、核膜を壊して核酸の断片化を行います。その後、遠心分離後の上清を回収することでタンパク質を回収することができます。
②タンパク質濃度の測定
タンパク質の濃度測定の方法には、BCA法、Bradford法(ブラッドフォード法)、Lowry法(ローリー法)などがあります。
タンパク質の定量法に関しては「1)タンパク質の定量法(BCA法、Bradford法、Lowry法)」で詳しく解説しています。
-
-150x150.png)
-
1)タンパク質の定量法(BCA法、Bradford法、Lowry法)
タンパク質の定量法(BCA法、Bradford法、Lowry法) タンパク質の濃度測定の方法には、BCA法、Bradford法(ブラッドフォード法)、Lowry法(ローリー法)などがあります。 BCA ...
続きを見る
④ゲル作製(濃縮ゲルと分離ゲル)
タンパク質を抽出し、タンパク質濃度を測定し終えたら、次に、タンパク質濃度が一定になるようにサンプルを調製したのち、SDS-PAGE(ドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動)を行って、タンパク質を分子量に応じて分離させます。
ここでは、電気泳動で使用するポリアクリルアミドゲルの作製について確認していきます。
SDS-PAGEで使用するポリアクリルアミドゲルは、濃縮ゲル(上層)と分離ゲル(下層)を重層させることによって作製します。
濃縮ゲル(上層)と分離ゲル(下層)の主な組成は以下のようになっています。
濃縮ゲル(上層)
| アクリルアミド(低濃度) | ビス含有のアクリルアミドを使用 |
| 濃縮ゲル用Buffer(pH6.8) | Tris-HCl、SDS含有 |
| APS(過硫酸アンモニウム) | TEMEDと一緒に使用することでアクリルアミドの重合を促進 |
| TEMED(テトラメチルエチレンジアミン) | APSと一緒に使用することでアクリルアミドの重合を促進 |
| H2O |
分離ゲル(下層)
| アクリルアミド(例:分子量70kDaのタンパク質を検出したい場合、終濃度10% など) | ビス含有のアクリルアミドを使用 |
| 分離ゲル用Buffer(pH8.8) | Tris-HCl、SDS含有 |
| APS(過硫酸アンモニウム) | TEMEDと一緒にアクリルアミドの重合を促進 |
| TEMED(テトラメチルエチレンジアミン) | APSと一緒に使用することでアクリルアミドの重合を促進 |
| H2O |
※分子量の小さなタンパク質を検出したい場合には、分離ゲルのポリアクリルアミド濃度を高くし、分子量の大きなタンパク質を検出したい場合には、分離ゲルのポリアクリルアミド濃度を低くします。
分離ゲルの上に濃縮ゲルを重層させる形でポリアクリルアミドゲルを作製します。このとき、分離ゲルを流し込んだ後、水を加えて上面を滑らかにし、分離ゲルが固まった後、水を取り除いて、最後に濃縮ゲルを流し込みます。
⑤SDS-PAGE(電気泳動)
○SDS-PAGE
SDS-PAGEに使用するバッファーの組成は以下のようになっています。
泳動バッファー
| Tris |
| グリシン |
| SDS |
※SDS-PAGEについての詳細は「1)SDS-PAGEの原理と概要」で解説しています。
⑥転写(ブロッティング)
SDS-PAGEによってタンパク質を分子量の大きさで分離できたら、次にメンブレンに転写させます。この操作をブロッティングといいます。
転写バッファー
| Tris |
| グリシン |
| メタノール |
○メンブレン
メンブレンとしては、PVDF(ポリフッ化ビニリデン)やニトロセルロースなどがよく使用されます。タンパク質の電荷や疎水性などに応じて、メンブレン表面への結合能力が左右されるため、最適なメンブレンを決定する必要があります。
※PVDF膜はニトロセルロース膜とは違って疎水性がかなり強いので、あらかじめメタノールに浸してから使用する点に注意しましょう。
○セミドライ式とタンク式
転写装置には、セミドライ式のものとタンク式のものがあります。
セミドライ式の転写装置は、使用するバッファー量が少ないといった特徴があります。タンク式の場合は高電流で冷却しながら転写を行います。
⑦ブロッキング
ウエスタンブロッティングでは、抗体を用いて特定のタンパク質を検出しますが、抗体の非特異的な結合を防ぐために、メンブレン膜への転写後に「ブロッキング」と呼ばれる操作を行います。
ブロッキング剤としては、BSA(ウシ血清アルブミン)などのタンパク質、スキムミルクなどが使用されます。
※ ブロッキング処理で防ぐことができるのは非特異的な反応のみで、目的のタンパク質のエピトープと同じエピトープがある他のタンパク質に抗体が特異的に結合してしまう反応を防ぐことはできません。
⑧一次抗体反応
目的のタンパク質に対する一次抗体を使用します(4℃、overnightなど)。
⑨二次抗体反応
一次抗体に対する二次抗体を使用します(常温、30分~1時間など)。
⑩検出
検出装置を使用して、検出や定量化を行います。
4.モノクローナル抗体とポリクローナル抗体
ウエスタンブロッティングでは、一次抗体としてモノクローナル抗体あるいはポリクローナル抗体が使用されます。ここでは、それぞれの抗体の違いについて解説していきます。
○モノクローナル抗体とポリクローナル抗体の違い
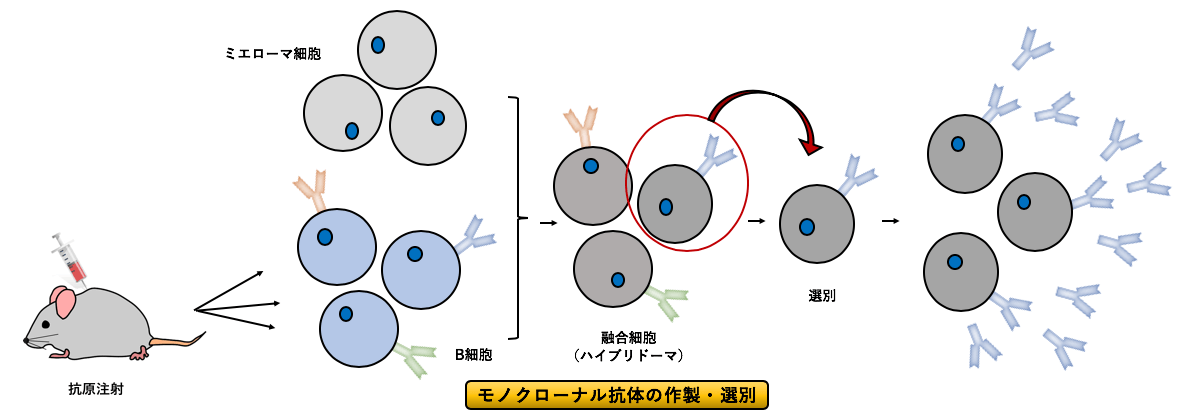
抗体は、B細胞が分化した抗体産生細胞によって作られます。このときB細胞はヘルパーT細胞から抗原の情報を受け取り活性化され、抗体産生細胞へと分化していきますので、それぞれのB細胞は抗原に対する特異的な抗体を産生する能力をもつことになります。
B細胞から生じた抗体産生細胞が産生する抗体は、抗原のもつエピトープ(抗原決定基)を認識して特異的に結合します。タンパク質などの大きな抗原には、エピトープが複数ありますので、1つの抗原には可変部の異なる複数の抗体が結合します。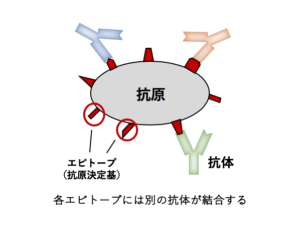 モノクローナル抗体とポリクローナル抗体の大きな違いは、このような抗原のもつエピトープを一つだけ抗体の標的として認識させるか、あるいは複数のエピトープを抗体の標的として認識させるかの違いにあります。モノクローナル抗体を用いる場合では、1種類の抗体が抗原のもつ1つのエピトープを認識して結合します。一方、ポリクローナル抗体を用いる場合では、複数の抗体が抗原のもつ複数のエピトープを認識して結合します。
モノクローナル抗体とポリクローナル抗体の大きな違いは、このような抗原のもつエピトープを一つだけ抗体の標的として認識させるか、あるいは複数のエピトープを抗体の標的として認識させるかの違いにあります。モノクローナル抗体を用いる場合では、1種類の抗体が抗原のもつ1つのエピトープを認識して結合します。一方、ポリクローナル抗体を用いる場合では、複数の抗体が抗原のもつ複数のエピトープを認識して結合します。
そのため、ウェスタンブロッティングでモノクローナル抗体を用いた場合には、特定のタンパク質を高い特異性で検出することができます。ポリクローナル抗体を用いた場合には多量の非特異的な抗体も含まれることになり、特異性は低くなります。しかしながら、モノクローナル抗体では、1つの一次抗体のみで特定のタンパク質を検出するため、その後の二次抗体による発光や発色が小さくなり、検出感度が低いことが欠点となります。一方、ポリクローナル抗体では二次抗体によって認識できる一次抗体(ポリクローナル抗体)の量が多いため、検出感度は高くなります。
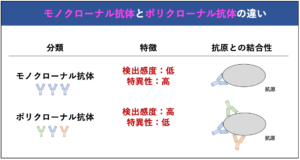
さらに、モノクローナル抗体の作製には、比較的手間がかかり高価であるといったことからポリクローナル抗体がよく用いられますが、ポリクローナル抗体ではロットごとに抗体の組成が異なってしまうため、実験目的に応じて適切な抗体を選択する必要があります。
※モノクローナル抗体とポリクローナル抗体の作製については「3)モノクローナル抗体とポリクローナル抗体の作製」で解説しています。
5.ウエスタンブロッティングとELISA法の違い
ELISA法とは、Enzyme-Linked Immuno Sorbent Assayの略で、ウエスタンブロッティングと同様に、特定タンパク質に対する一次抗体と一次抗体に対する二次抗体を用いたタンパク質の検出が行えます。
両者の決定的な違いは、分子量に基づいてタンパク質を分離するかどうかにあります。ウエスタンブロッティングでは、SDS-PAGEによって分子量に応じたタンパク質の分離を行いますが、ELISA法では分子量に応じた分離は行いません。
また、ウエスタンブロットでは、目的タンパク質が分解を受けて分解物を生じた場合でも、目的タンパク質の分子量の大きさが異なったバンドとして検出することができますが、ELISA法では両者を分離して検出することはできません。
ELISA法では、多量の検体を一度に調べることができるという利点がありますが、ウェスタンブロットとは違って非特異的な反応があってはいけません。ウェスタンブロットの場合、非特異的なバンドが検出された場合であっても、明らかに分子量の異なる部位に見られたバンドがあれば無視してもよい場合がよくあります。
6.ウエスタンブロッティングの応用
ウェスタンブロッティングでは、ファージに組み込んだcDNAライブラリー由来の発現タンパク質を目的タンパク質に対する抗体で検出することで、目的タンパク質の遺伝子をクローニングをすることができます。
この原理を利用した方法として、DNA結合タンパク質(転写調節因子など)やRNA結合タンパク質、特定のタンパク質と相互作用するタンパク質の遺伝子クローニングにも応用することができます。ちなみに、これらの方法は、それぞれ「サウスウエスタン法」「ノースウエスタン法」「ファーウエスタン法(ウエストウエスタン法)」と呼ばれています。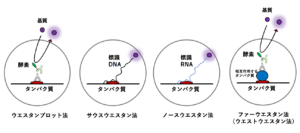
ウエスタンブロッティングについてはこれで以上です。
次は「3)モノクローナル抗体とポリクローナル抗体の作製」について学んでいきましょう。
-
-
3)モノクローナル抗体とポリクローナル抗体の作製
今回は「モノクローナル抗体とポリクローナル抗体の作製」について解説していきますが、モノクローナル抗体とポリクローナル抗体の違いについては「2)ウエスタンブロッティング(モノクローナル抗体とポリクロー ...
続きを見る