アガロースゲル電気泳動とPAGE
「4)アガロースゲル電気泳動」でも詳しく解説していますが、電気泳動には、分離したい物質の違いによってアガロースゲル電気泳動とポリアクリルアミドゲル電気泳動(PAGE)の大きく2つがあります。
前者はアガロースゲルを用いた電気泳動のことでDNAやRNAといった核酸の分離に、後者はポリアクリルアミドゲルを用いた電気泳動のことで主にタンパク質の分離に用いられます。

ポリアクリルアミドゲル電気泳動の原理について理解する前に、タンパク質を構成するアミノ酸の電離平衡と電荷について理解しておきましょう。
アミノ酸の電離平衡と電荷
アミノ酸は、水溶液中では陽イオンと双性イオンと陰イオンが平衡状態にあります。そのため、水溶液中のpHが変化すると平衡が移動し、それぞれのイオンの割合が変化します。

このように、水溶液中のpHの変化によってアミノ酸の電荷は変化しますが、これは、アミノ酸がもつα-アミノ基(-NH3)とα-カルボキシル基(-COOH)および側鎖のイオン化する基の水素(H)がH+として電離するためです。
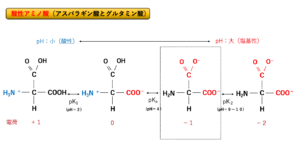
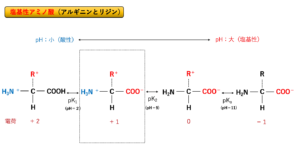
生体のタンパク質は、20種類のアミノ酸をもとに構成されていますが、それらのアミノ酸は中性アミノ酸、酸性アミノ酸、塩基性アミノ酸の3種類に分類されます。中性アミノ酸では等電点(正と負の電荷の和が0になるときのpH)が中性付近に、酸性アミノ酸(アスパラギン酸とグルタミン酸)では等電点が酸性付近に、塩基性アミノ酸(ヒスチジン、アルギニン、リジン)では等電点が塩基性付近にあります。(図中のpK1やpK2はα-アミノ基とα-カルボキシル基のpKaを意味しています。)
そのため、生理的条件下(pH7.4)において、酸性アミノ酸であるアスパラギン酸やグルタミン酸はマイナスに荷電していますが、塩基性アミノ酸であるアルギニンやリジンはプラスに荷電しています。
※イミダゾール基をもつヒスチジン も塩基性アミノ酸ですが、遊離アミノ酸としてのpKa値とタンパク質内でのpKa値は異なり少し複雑ですが、これがヒスチジンが酵素活性部位でのプロトン移動に重要な役割を担う理由となっていると考えられています。
このように、アミノ酸のイオン化状態は、周囲のpHと各アミノ酸のpKa値によって変化するということがわかりますが、アミノ酸が修飾(リン酸化など)を受けた場合には、さらに多くのイオン化しうる基をもつことになりますので、タンパク質中に多様に荷電したアミノ酸側鎖をもたらすことになります。たとえば、リン酸化を受けるアミノ酸には-OHをもつセリン、スレオニンおよびチロシンがありますが、これらのアミノ酸はリン酸化を受けることによって負に荷電することになります。
ポリアクリルアミドゲル電気泳動の原理と種類
ポリアクリルアミドゲル電気泳動には、主に①SDS-PAGE、②Native-PAGE、③等電点電気泳動、④二次元電気泳動の4種類がありますので、以下にそれぞれの手法の原理と特徴について解説していきます。
①SDS-PAGEの原理と特徴
タンパク質を電気泳動させると、小さなタンパク質はゲルの網目にひっかからずに早く移動し、大きなタンパク質はゲルの網目に引っかかるためゆっくりと移動します。しかしながら、このときタンパク質がゲルの網目を移動する速さは、個々のタンパク質の分子量だけではなく、タンパク質を構成する各アミノ酸の電荷や高次構造によって影響を受けます。
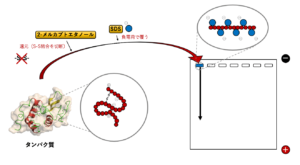
SDS-PAGEでは、タンパク質試料にドデシル硫酸ナトリウム(SDS)と2-メルカプトエタノールを処理し、その後、加熱により熱変性させます。SDSは負に電荷した界面活性剤で、タンパク質の主ペプチド鎖部分に一定の割合で結合し、タンパク質を負電荷で覆う性質があります。一方、2-メルカプトエタノールは還元剤で、ジスルフィド結合を開裂し、タンパク質がもつ非共有結合性の相互作用を失わせることで、SDSとともにタンパク質を変性させる性質をもちます。
そのため、SDSと2-メルカプトエタノールで処理したタンパク質試料では、変性したタンパク質がほぼ均一の負電荷を帯びた直鎖状分子となり、電場中ではその分子量に応じて陽極に引き寄せられるようになります。このような原理でタンパク質を分子量に依存して分離することができるため、SDS-PAGEでは、タンパク質の純度を評価したり、分子量を見積もったりすることができます。
※未知タンパク質の分子量は、同じゲルで泳動させた分子量マーカーの移動度と比較して見積もることができます。
②Native-PAGEの原理と特徴
タンパク質の電気泳動法には,SDS-PAGEの他にも何種類かあり、Native-PAGEもポリアクリルアミドゲル電気泳動 (PAGE) の一種ですが、Native-PAGEとSDS-PAGEの決定的な違いはタンパク質を変性させるかどうかにあります。(Native-PAGEの「Native」という語は「タンパク質本来の状態で」ということを意味しています。)
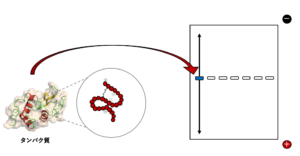
Native-PAGEでは、SDS-PAGEとは違いタンパク質を未変性のまま泳動するため、タンパク質の高次構造が維持されます。そのため、ゲル中でも活性を維持する場合が多く、電気泳動後のタンパク質でも酵素活性を測定する場合にNative-PAGEは使用されます。しかしながら、Native-PAGEでのタンパク質の移動度は、そのタンパク質の等電点、分子量の他に、高次構造や複合体形成などさまざまな要因によって左右されてしまうため、目的タンパク質の分子量の測定を行う場合にはSDS-PAGEを行うことが望まれます。
また、タンパク質の電荷によって、陽極に分離されるものと陰極に分離されるものが存在するため、目的のタンパク質がどちらの極に分離されるのかを把握し、バッファーのpHの選択などを慎重に検討する必要があります。(塩基性のタンパク質は陰極側に泳動してしまうので注意が必要です。)
③等電点電気泳動の原理と特徴
タンパク質は正負の電荷の総和が0になるpH(これを等電点といいます)では、電気泳動のゲルの中で陽極にも陰極にも移動しません。等電点電気泳動は、pH勾配をもつゲルの中でこの等電点を利用してタンパク質を分離する方法になります。
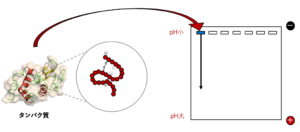
等電点に達したタンパク質は、タンパク質分子間の引力がもっとも大きくなりますので、タンパク質の溶解度は最小になり、目的タンパク質が沈殿してきます。しかしながら、等電点電気泳動では、等電点が同じタンパク質は同じ位置でのバンドを生じてしまうため両者を分離することはできません。
④二次元電気泳動の原理と特徴
二次元電気泳動は、等電点電気泳動とSDS-PAGEを組み合わせた方法で、それぞれの電気泳動法に比べて、非常に高い分離能でタンパク質を分離することができます。そのため、非常に多数のタンパク質を一度に分離でき、プロテオーム解析などに利用されています。
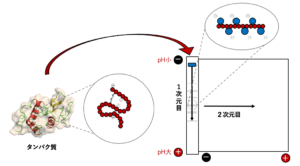
タンパク質はそれぞれ固有の電荷と分子量をもちますが、二次元電気泳動では、まずpH勾配をもつ非変性ゲルを用いた等電点電気泳動で固有の等電点のpH位置まで分離させ(1次元目)、次に分離した個々のタンパク質をSDS-PAGEでさらに分離させます(2次元目)。SDSはタンパク質を負電荷で覆ってしまうため、1次元目で等電点電気泳動を行う必要があります。
この手法を用いることで、コントロールと比較してタンパク質発現量の差異やリン酸化などの修飾を解析することができます。二次元電気泳動によって分離したタンパク質からペプチド断片を得て、質量分析を行うことでタンパク質の同定を行うこともできます。
SDS-PAGEの原理と概要についてはこれで以上です。
次は「2)ウエスタンブロッティング」について学んでいきましょう。
-
-
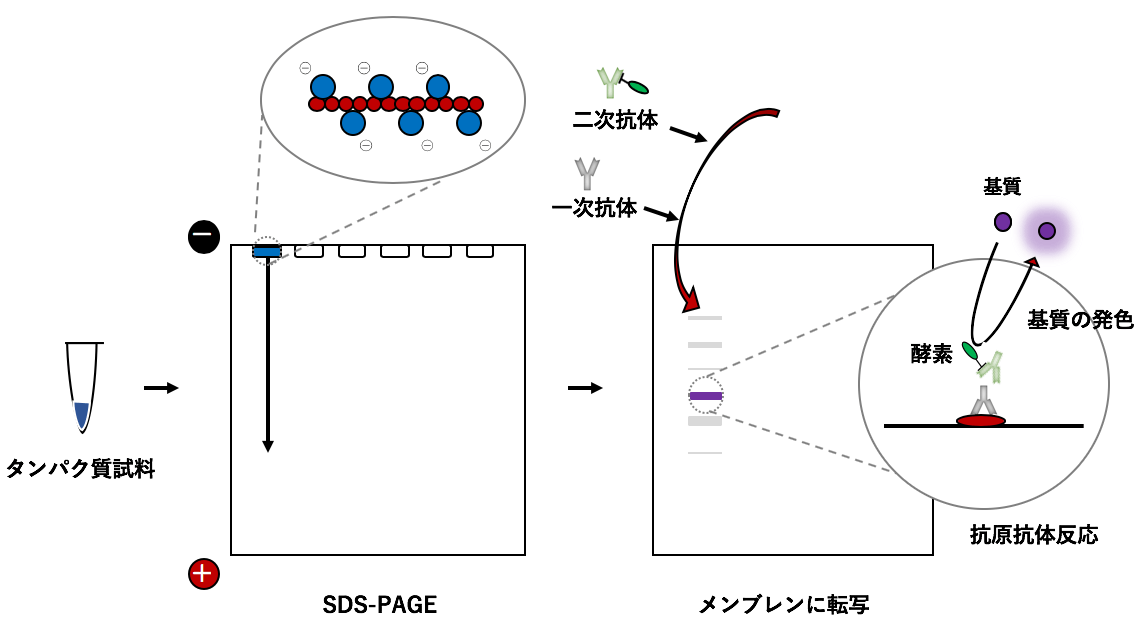
2)ウエスタンブロッティング
1.ウエスタンブロッティング(WB)とは ウエスタンブロッティングとは、SDS-PAGEによって分離したタンパク質を疎水性膜(メンブレン)に転写し、任意のタンパク質に対する抗体を用いて特定のタンパク ...
続きを見る