1.リアルタイムPCRとは
リアルタイムPCRとは、PCRによる増幅産物をリアルタイムでモニタリングすることで、増幅率に基づいて初期のDNAの定量ができる定量PCRのことです。
リアルタイムRT-PCR法は、mRNAの発現量を定量的に測定する目的でよく使用されています。また、SNPのタイピングなどの目的でもリアルタイムPCR は使用されます。
○従来のPCRとリアルタイムPCRの違い
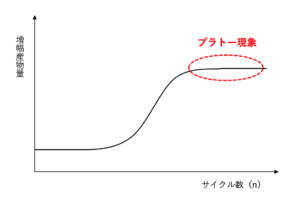
「1)PCRの原理と概要」でも確認したように、PCRでは理論的には2のn乗(2n)倍に鋳型のDNAが増幅していきますが、いずれPCRの基質(dNTP)やプライマーの枯渇などにより、プラトー現象と呼ばれる現象が起こります。
そのため、従来のPCRでは、数十回のPCRサイクルを行なった後にDNAが十分に増幅されたかどうかは確認できますが、初期のDNA濃度に数倍の差があったとしても、数十回のPCRサイクル後には増幅産物の量に差が見られなくなるため、初期DNA量の定量を行うことはできませんでした。
一方、リアルタイムPCRでは、PCRによる増幅産物をリアルタイムでモニタリングするという特徴から、その増幅率に基づいて初期のDNA量の定量を行うことができます。
○リアルタイムPCRの利用
リアルタイムPCRの主な特徴を確認しておきましょう。
①初期のDNA 量を正確に定量できること
②蛍光物質を利用し、PCRサイクルごとに増える蛍光を検出すること
③電気泳動を行う必要がないこと

2.リアルタイムPCRの原理
リアルタイムPCRでは、PCRによって増幅するDNA量をモニタリングする手法として「蛍光物質」を利用しています。リアルタイムPCRには、蛍光の検出方法の違いから主に以下の2つの方法があります。
①インターカレーション法
②ハイブリダイゼーション法
①インターカレーション法
インターカレーション法は、二本鎖DNAの鎖間に入り込み蛍光を発する色素(SYBR Green Ⅰなどの蛍光物質)を用いる方法です。二本鎖DNAの鎖間に入り込むことをインターカレートといいます。
この方法では、PCRの伸長反応のときに二本鎖DNAの中に取り込まれた蛍光物質の蛍光強度を測定することによって、増幅したDNA量を測定することができます。
この方法は安価で使用しやすいのですが、SYBR Green Ⅰは特異性がないため、どの二本鎖DNAにも結合してしまい、非特異的に増幅してしまったDNAも測定されるといった欠点があります。そのため、非特異的なDNAの増幅が生じたかどうかは、リアルタイムPCR後の融解曲線分析によって確認します。

②ハイブリダイゼーション法
ハイブリダイゼーション法は、蛍光物質で標識したDNAプローブ(鋳型DNAの内部配列をもつ)を用いる方法です。
蛍光標識したDNAプローブは、PCRサイクルにおけるアニーリングの段階でPCRプライマーと同様に、鋳型DNAにハイブリダイゼーションするため、そのハイブリダイズしたDNA量を蛍光強度を測定することで求めることができます。
この方法には用いるプローブの違いによって、以下の2種類の方法があります。
⑴TaqManプローブを用いる方法
⑵FRETプローブを用いる方法
⑴TaqManプローブを用いる方法
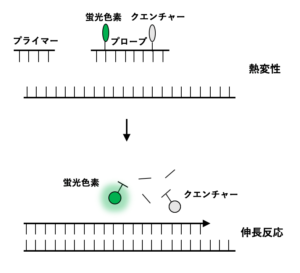
TaqManプローブ法は、蛍光色素とクエンチャー(消光物質)を結合させたDNAプローブを用いる方法です。
アニーリングの段階で、蛍光色素とクエンチャーを結合したDNAプローブが鋳型DNAに結合しますが、PCRの伸長反応の段階で、このDNAプローブが切断されるため、クエンチャーによって抑制されていた蛍光色素からの蛍光が発せられるようになります。
⑵FRETプローブを用いる方法
FRETとは、蛍光共鳴エネルギー転移(Fluorescence Resonance Energy Transfer)のことです。FRETの原理は、2種類の蛍光物質が近くに存在し、片方の蛍光物質が励起状態(エネルギーが高い状態)にある場合、もう片方の基底状態(エネルギーが低い状態)の蛍光物質に励起エネルギーの転移が起こり(これを共鳴といいます)、励起状態にあった蛍光物質がエネルギーを失って基底状態に戻り、もう片方の基底状態にあった蛍光物質がエネルギーを受け取って励起状態に変化するというものです。
FRET法では、このように異なる2種類の蛍光物質で標識したDNAプローブを用いて、鋳型DNAと両者が結合し、共鳴するによって励起エネルギーを受け取った蛍光物質の蛍光を測定する方法になります。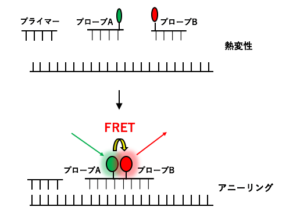
○リアルタイムPCRで初期のDNA量が定量できる原理
リアルタイムPCRでは、増幅するPCR産物量をサイクルごとに蛍光物質で標識し、その蛍光強度を測定することで増幅曲線を作成します。初期の DNA 量が多ければ多いほど、増幅するPCR産物量が検出可能な量に達するまでのサイクル数(PCRの初期ではその蛍光強度が検出限界以下であるために増幅曲線を得られません)が少なくて済むため、より少ないサイクル数で増幅曲線が起き上がっていきます。
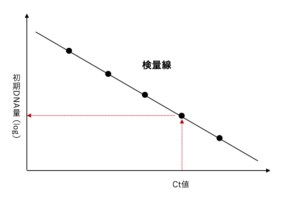
したがって、段階希釈したスタンダードサンプルを用いてリアルタイム PCR 反応を行うと、初期の DNA 量が多いサンプルから順に等間隔で並んだ増幅曲線が得られます。ここで、適当なところに閾値線(Threshold Line)を設定すると、増幅曲線と交わる点「Ct 値(Threshold Cycle)」が得られます。
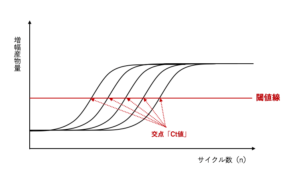
このように、段階希釈したスタンダードサンプルの初期DNA量とそれぞれのCt値に関するデータが得られますが、これらの関係をもとに下図のような「検量線」を作成することができます。そのため、未知サンプルから求めた Ct 値をこの検量線に当てはめれば、未知サンプルの初期DNA量を求めることができます。
3.リアルタイムPCRによる定量法
リアルタイムPCRを使った定量法には、絶対定量と相対定量の2種類があります。絶対定量と相対定量の大きな違いは、検量線を作成するためのスタンダードサンプルの違いにあります。
①絶対定量
絶対定量では、段階希釈した濃度既知のスタンダードサンプルから検量線を作成し、未知濃度のサンプルの定量を行います。
この手法では、細菌やウイルスなどのDNAの絶対量を測定できるため、どれくらいの細菌やウイルスが存在するかを測定する場合などに適した方法になります。
②相対定量
相対定量では、スタンダードサンプルにおける正確なDNA濃度の決定は必要ではなく、そのサンプルの希釈系列から検量線を作成し、目的遺伝子とリファレンス遺伝子(内部標準遺伝子ともいいます)の相対的濃度を測定し、リファレンス遺伝子に対する未知濃度サンプルの相対的濃度の比較定量を行います。つまり、相対定量法では、発現量を求めたい目的遺伝子の他に、必ずリファレンス遺伝子の測定も行う必要があります。
比較定量とは、目的とする未知濃度サンプルの量をリファレンス遺伝子の量で標準化(目的遺伝子量÷リファレンス遺伝子量で求める)し、その標準化した値を用いてサンプル間で比較することをいいます。リファレンス遺伝子は、遺伝子発現解析の場合、通常GAPDHやβアクチンなどのハウスキーピング遺伝子が用いられます。
この手法は、主に遺伝子発現解析に用いられる方法で、例えば、がん細胞と正常細胞である遺伝子の発現量が相対的に何倍多く(あるいは少なく)発現しているかを推定する場合などに適した方法になります。

上図は、がん細胞と正常細胞の遺伝子発現量の相対値を示したものです。この例では、まず段階希釈したスタンダードサンプルを用いて目的遺伝子とリファレンス遺伝子の検量線を作成し、作成した検量線から、がん細胞と正常細胞で発現する目的遺伝子とリファレンス遺伝子の発現量を相対定量しています。がん細胞と正常細胞の目的遺伝子の発現量は、それぞれ相対値で4と16となっていますが、これらの値はリファレンス遺伝子の発現を用いて正常化すると、がん細胞では0.5(4÷8)、正常細胞では1(16÷16)となります。このことから、目的遺伝子の発現量は、がん細胞において正常細胞の半分に減少していることが推測できます。
〈ΔΔCt 法〉
リアルタイムPCRにおける相対定量の場合、スタンダードサンプルを用いることなく、検量線を作成することもなく、目的遺伝子とリファレンス遺伝子から求めた閾値線に達するまでのサイクル数(Ct値)の差を比較することで未知サンプル間の遺伝子発現の変動を比較する解析方法もあります。この手法は、操作が簡便であることからよく使用されている解析法になっています。
しかしながら、測定するすべての遺伝子について PCR 増幅効率がほぼ一定であることが大前提となりますので、あらかじめ各遺伝子についてのPCR 増幅効率を調べておく必要があります。
ΔΔCt 法(デルタ・デルタCt法)では、目的遺伝子とリファレンス遺伝子の増幅効率が限りなく1に近い場合には1サイクルのPCR反応でDNA量が2倍に増幅されるという原理に基づいて解析を行います。まず目的遺伝子とリファレンス遺伝子のCt値の差(これをΔCt値といいます)を求め、さらに未知サンプル間のΔCt値の差(ΔΔCt値)を求めることで、未知サンプル間の遺伝子発現量の差を比較定量します。この手法では、検量線を作成する必要がないので、サンプル数が多い場合に特に用いられる手法になります。

上図の例で、がん細胞と正常細胞でΔΔCt 法を行う場合、まず両者における目的遺伝子とリファレンス遺伝子のΔCt値(がん細胞:ΔCt値=21−20=1、正常細胞:ΔCt値=19−19=0)を求め、さらにがん細胞と正常細胞間のΔΔCt値(ΔΔCt値=1−0=1)を求めます。最後に、このようにして求めたΔΔCt値から2-ΔΔCt値(2-1=0.5)を求めると、がん細胞では正常細胞と比較して目的遺伝子の発現量は半減しているということがわかります。
4.デジタルPCR(次世代PCR)
リアルタイムPCRとは全く異なるアプローチでDNAの検出や定量を行う次世代PCRとしてデジタルPCRというものもあります。
DNAを含むPCR反応液を多数の微分画に分割し、個々の微画分においてPCR反応を行うと、PCRによって増幅されたDNAを含む画分(ポジティブ反応として検出される)とPCRによって増幅されたDNAを含まない画分(ネガティブ反応として検出される)が生じます。
デジタルPCRでは、PCR後の各微画分におけるシグナルの有無を検出することによって、ネガティブ反応として検出された微画分の割合から、サンプル中に含まれる目的DNAの絶対定量を行うことができます。また、デジタルPCRによる定量PCRには、個々のPCR増幅効率が定量には影響せず、スタンダードサンプルやリファレス遺伝子を用いた比較を行う必要がないといった特徴があります。
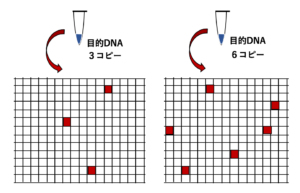
デジタルPCRでは、DNAを含むPCR反応液を多数の微分画に分割するため、DNAを含む画分では元のDNA溶液よりも濃縮されていることになります。そのため、通常のPCRでは増幅できないほどの極端に薄い鋳型DNAからでもPCRを行うことができます。
リアルタイムPCRによる定量PCRについてはこれで以上になります。
次は「4)アガロースゲル電気泳動」について学んで行きましょう。
-
-
4)アガロースゲル電気泳動
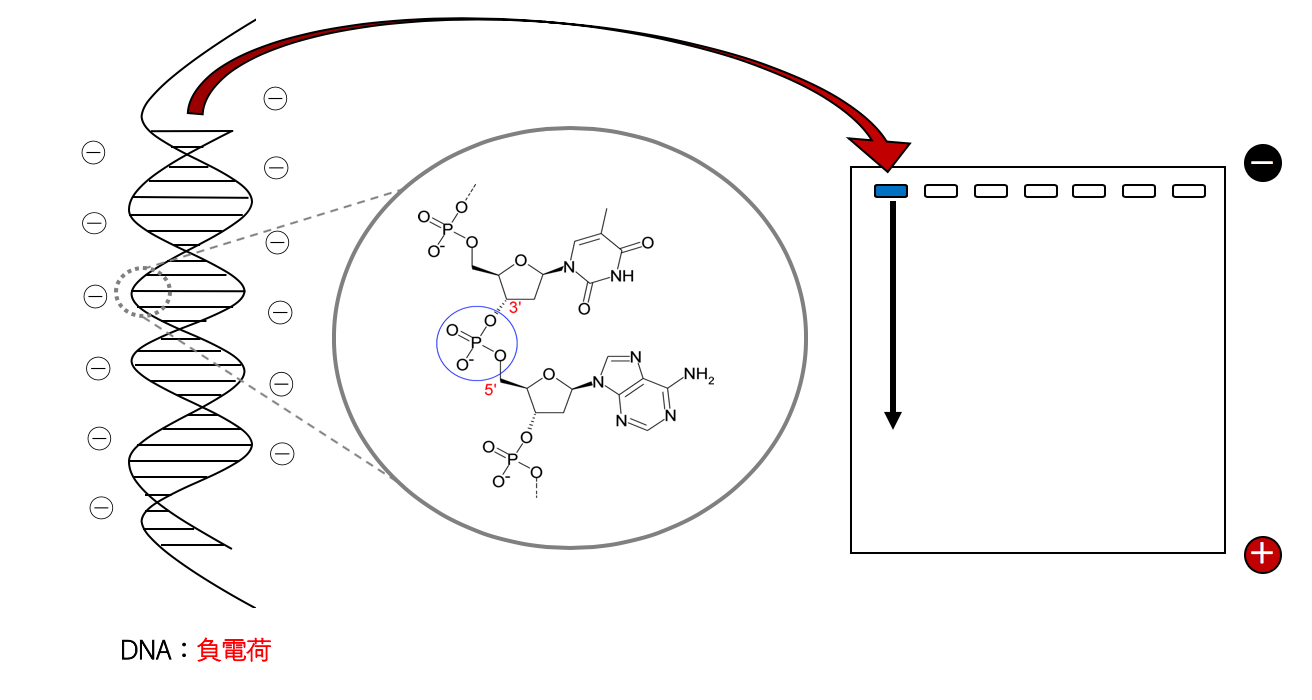
電気泳動とは 電気泳動とは、核酸(DNAやRNA)やタンパク質などの電荷をもった物質を電場を利用して分離するための手法のことをいいます。 核酸やタンパク質といった電荷をもつ物質は、電流を流したとき ...
続きを見る