1.クロマトグラフィーとは
クロマトグラフィーとは、ある物質を分離・精製する方法の一つで、互いに混じり合わない二つの相である固定相と移動相を用いて、2種類以上の混合物から単一の物質を分離・精製することができる手法です。
2.クロマトグラフィーの分類
クロマトグラフィーは、固定相と移動相の2つの相を用いた分離・精製を行いますが、クロマトグラフィーには、固定相の支持体の違いによる分類の仕方と移動相の違いによる分類の仕方があります。
○移動相の違いによる分類
移動相の違いによる分類では、移動相が気体であるガスクロマトグラフィーと、移動相が液体である液体クロマトグラフィーの2種類があります。
○固定相の違いによる分類
固定相の支持体の違いによる分類では、固定相をカラムと呼ばれる筒に充填して用いるカラムクロマトグラフィーと、固定相を平面板上に塗布して用いる薄層クロマトグラフィーの2種類があります。

3.カラムクロマトグラフィーの原理
カラムクロマトグラフィーとは、カラムという筒にさまざまな物理化学的性質をもった樹脂ビーズなどの担体を詰め、そこに種々の混合物を流すことで、単一の物質を分離・精製することができる手法のことです。
カラムクロマトグラフィーには、カラム樹脂の違いからゲル濾過クロマトグラフィー、イオン交換クロマトグラフィー、アフィニティークロマトグラフィーなどさまざまな種類があります。

以下に、タンパク質の分離・精製を例としてカラムクロマトグラフィー法の原理を解説していきます。
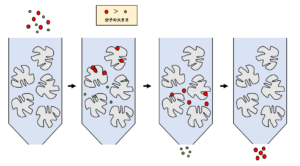
①ゲル濾過クロマトグラフィー
ゲル濾過クロマトグラフィーとは、分子ふるい効果によりタンパク質などを大きさに応じて分離する方法です。ゲル濾過カラムの担体は、多くの孔をもった網目構造になっているため、大きな分子は網目に入り込まずに早く溶出されますが、小さな分子ほど孔に入り込んでしまうため、ゆっくりと溶出されます。
ゲル濾過クロマトグラフィーでは、タンパク質を分子量に応じて分離することができるだけでなく、分子量が既知の標準タンパク質との比較することによる分子量の推定や脱塩、バッファー交換などの操作に利用することができます。
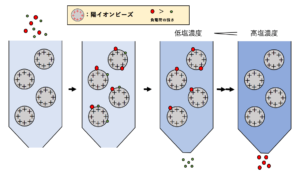
②イオン交換クロマトグラフィー
イオン交換クロマトグラフィーとは、担体に詰めた負電荷および正電荷をもつイオン交換樹脂との静電的相互作用をもとに、タンパク質を電荷の違いによって分離する方法です。
タンパク質には、構成するアミノ酸の違いにより、正電荷を多く含むものもあれば負電荷を多く含むものもあります。そのため、カラムに吸着したタンパク質の溶出のときに低塩濃度から高塩濃度へとグラジエントをかけたり、pHを変化させたりすることで、結合が弱い順にタンパク質を分離することができます。
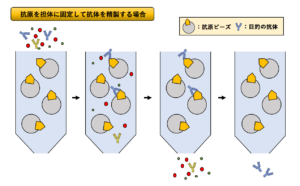
③アフィニティークロマトグラフィー
アフィニティークロマトグラフィーとは、担体に固定した物質との親和性を利用して、タンパク質を精製する方法です。アフィニティーとは親和性のことで、リガンドと受容体、抗原と抗体、Ni2+とHis-タグ、アビジンとビオチンなど、お互いが特異的に結合する性質を利用してタンパク質を精製できます。
目的タンパク質と親和性をもつリガンドを担体に固定したカラムを用いることで、目的タンパク質を精製することができるため、特定のDNA鎖を固定化して転写因子などのDNA結合タンパク質を精製することもできます。さらに、抗体を用いた方法では、目的タンパク質と相互作用しているタンパク質も一緒に回収することもできます。
カラムクロマトグラフィーの原理と概要についてはこれで以上です。
次は「1)SDS-PAGEの原理と概要」について学んで行きましょう。
-
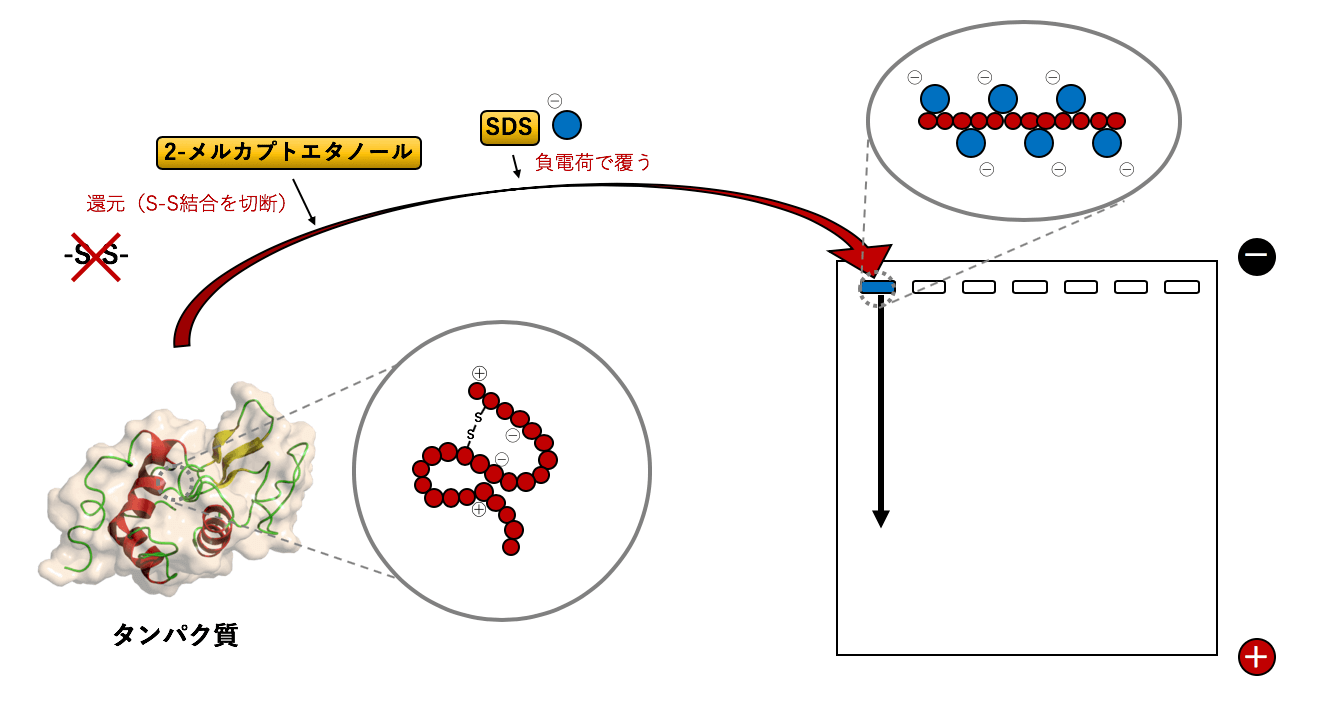
-
1)SDS-PAGEの原理と概要
アガロースゲル電気泳動とPAGE 「4)アガロースゲル電気泳動」でも詳しく解説していますが、電気泳動には、分離したい物質の違いによってアガロースゲル電気泳動とポリアクリルアミドゲル電気泳動(PAGE ...
続きを見る
【参考】
