1.反応速度
反応速度とは、単位時間あたりの反応物(あるいは生成物)の濃度変化のことをいいます。

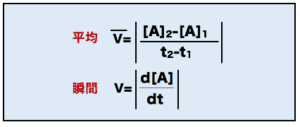
○反応速度の定義
それでは、以下のような化学反応について考えてみましょう。
![]()
まず、ある時間t1からt2における反応速度は、「反応物Aの濃度変化Δ[A](濃度の変化量)」を「時間t1からt2までの変化量Δt(時間の変化量)」で割った値となりますので、2点を通る直線の傾きの絶対値として表すことができます。これは、時間t1からt2における平均の反応速度を示しています。
※「傾き=Yの増加量/Xの増加量」であることを思い出しましょう。
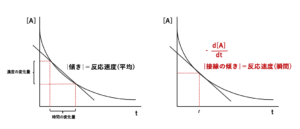
※上図では、傾きが負になりますが、反応速度は常に正となりますので傾きの絶対値をとります。
次に、ある時間tにおける反応速度は、「微小濃度変化Δd[A](濃度の変化量)」を「微小時間dt(時間の変化量)」で割った値となりますので、接線の傾きの絶対値として表すことができます。これは、時間tにおける瞬間の反応速度を示しています。
次は、以下のような化学反応を見ていきましょう。多くの化学反応では、以下のように反応に関わる反応物と生成物の濃度が等しいとは限りません。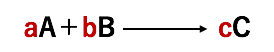
この例の化学反応式からは、反応物AとBがそれぞれa、b(mol)減少し、生成物Cがc(mol)増加することが分かります。この場合には、それぞれの反応速度を各係数(a、b、c)で割ることによって、全体としての反応速度を求めることができます。
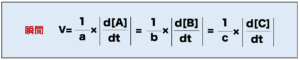
【例1】
A+B→2Cの反応において、Cの濃度が10~30秒の間に4mol/L増加した。このときの全体の反応速度とCの反応速度を求めよ。
【解説】
時間の変化量は30-10=20(秒)、[C]の変化量は4(mol/L)なので、
Cの反応速度:$$v_c=\vert \frac{[C]_2-[C]_1} {t_2-t_1}\vert =\vert \frac{4}{20} \vert=0.2$$(mol/L・秒)
全体の反応速度:$$v=\frac{1}{c} \times\vert\frac{[C]_2-[C]_1 }{t_2-t_1}\vert=\frac{1}{2} \times\vert-\frac{4}{20}\vert=0.1$$(mol/L・秒)
【解答】
Cの反応速度:0.2mol/L・秒、全体の反応速度:0.1mol/L・秒
2.酵素反応速度
酵素反応では、酵素(E)に基質(S)が結合し、一旦、酵素-基質複合体(ES)を形成した後、生成物(P)が酵素から解離します。(E=enzyme、S=substrate、P=Product)
一般的に、酵素反応式は以下のような式で表されます。
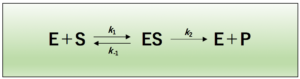
酵素反応速度の考え方は、反応の最初の段階には生成物は存在しないということを前提としています。つまり、初期反応では、生成物(P)が酵素(E)に結合して基質(S)を生成するという逆反応は無視できます。
酵素の初期反応速度(v0)は、酵素濃度 [E]が増加するとともに増加していきます。そのため、酵素反応速度を求めるときには、基質濃度の変化のみによって酵素反応速度が変化するような条件にするために、酵素濃度を一定にした状態で実験を行います。
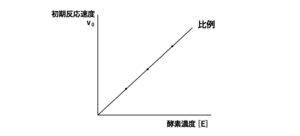
○ある基質濃度[S]における酵素反応速度の求め方
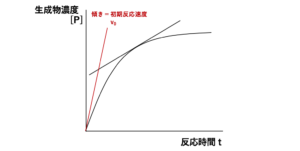
例えば、ある一定の基質濃度[S]における酵素反応速度を求めたい場合、基質(S)が生成物(P)に変化する反応速度を考えます。つまり、S → P の反応速度を求めるわけですが、時間が経過して反応が進むにつれて反応液中の基質濃度[S]は減少していくため、生成物濃度[P]の増加が次第にゆっくりになります。
そのため、反応時間のどのタイミングで接線の傾きを求めるかによって、接線の傾きは変化してしまいます。このことから、酵素反応速度を求めるときには、反応開始時(t0)における接線の傾きから、反応開始時の酵素反応速度(初期反応速度)を求めます。
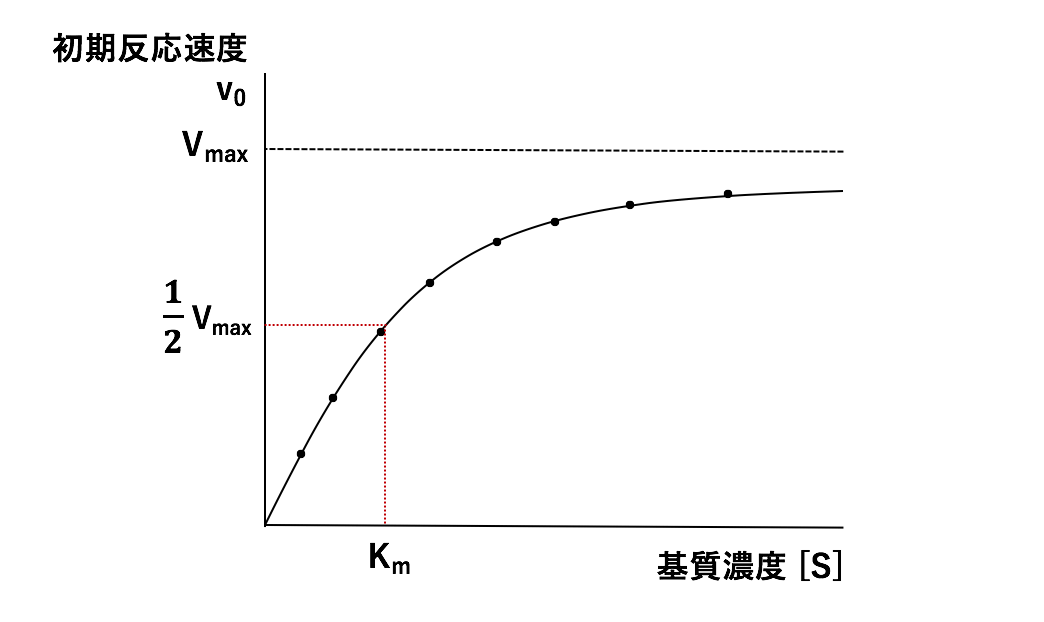
基質濃度[S]を変化させると、酵素反応速度も変化することから、さまざまな基質濃度[S]における初期反応速度を求めることにより、ミカエリス・メンテンの式で表される曲線を得ることができます。これについては「2)ミカエリス・メンテンの式と反応速度論量の決定 (Km値とVmax)」で詳しく解説していきます。
反応速度と酵素反応速度についてはこれで以上です。
次は「2)ミカエリス・メンテンの式と反応速度論量の決定 (Km値とVmax)」について学んでいきましょう。
-
-
2)ミカエリス・メンテン式と反応速度論量の決定 (Km値とVmax)
ミカエリス・メンテンの式を用いると、反応速度論量(Km値とVmax)を決めることができますが、その前段階として、酵素反応速度の求め方を知っておく必要があります。酵素反応速度の求め方については「1)反 ...
続きを見る